化学解析:电极电势的理解与应用
化学 电极电势怎么理解
您的问题真的很脏。让我弄清楚它:首先,双电极层的理论是解释电极电势的基础。
将金属放在溶液中。
这种电离通常非常弱(否则将金属迅速溶解在溶液中),并且很难将金属表面放入溶液中。
散落在溶液中)。
我们可以使用M+/M来提出这种情况。
好吧,很明显,目前,接口上的电荷分离,因此生成了界面上的电势。
只要收费分开,潜力就应该有所不同,这是他在高中物理学中研究的。
除了标准电极。
现在无法通过普通方法来测量接口的差异。
实际上,它的绝对含义根本不知道。
为什么? 通常,我们实际上称呼的“潜力”是地球的潜力。
如果我将金属放在溶液和地面中,则金属和地球正在等待。
然后,您可以知道M+/M中与地球相关的M+/M中的电势之间的差异。
但是,即使您不考虑其他测量困难,也很难认为应该有M+附近的金属材料。
由于这种其他金属材料也形成了界面,例如溶液中的M1+/M1,更不用说M+/M电位的第一个差异了,现在电力差异不明。
但是,最后,界面的两个电势之间的差异仍然很简单。
我们连接两个M1和M1金属金属。
相等,我们是相等的。
目前,需要标准电极。
如果我们能找到电极,则溶液中M+/M界面的电势并没有改变,我们将其视为标准,并且与该标准电极相比,测量其他电极电位,以便可以使用此测量所有其他电极与此标准电极相比,标准电极与此标准电极相比。
标准氢电极是具有固定电势的电极,不是测量。
后来由于标准氢电极必须是氢气,使用不方便,于是又开发了Ag/Agcl电极、饱和甜汞电极等参比电极,方便一般实验。
要知道,任何氧化反应都可以转化为原电池,也就是我们常说的。
但你可以更好地理解你可以做得更好的例子。
你是什么意思? 让我们看一下反应 Cu+NO3 --- “Cu2++ 否。
将其分为两个反应,即 Cu-2E->CU2+、NO3-+e->no(我们只是说这个概念不值得) ? 这些反应相对于单质电极来说,如果Cu在0.2V时被氧化成Cu2+,而no3-还原成NO则只有0.3V,这意味着氧化能力。
硝酸根足以氧化Cu2+。
虽然可以想象这两半的反应可以形成原电池,但并不是必须形成原电池。
另外,要半尾铜,可以用Cu来进行。
吸附成Cu2+,也可以用铂电极还原Cu2+中的Cu,观察其电极电位,同样,NO3-也不需要实际吸附PT电极。
。
目前,我们提到的理论也是这样使用的:对于Cu->Cu2+的例子,双电层表明该界面将具有由双电层引起的电势。
即使不使用Cu作为电极,只要发生这种反应(例如铜离子沉积在铂电极上),电极处就不可避免地会出现Cu2+/Cu界面。
换句话说,只要在铂上沉积一个 Cu 原子,就会形成 Cu2+/Cu 界面。
那么这个Cu2+/Cu界面的电势就存在。
知道可以使用铂电极测量铜,我们也知道为什么可以测量非金属。
除非你确实需要使用非金属来制造电极,否则这是不可能的。
当电极表面形成NO和NO3-两种物质时,前后反应,两种物质之间的转化将产生电极电位。
(或以这种方式理解的是,NO和NO3之间的转换伴随着能量的变化。
这种能量是一种电极电位,因为电势能是一种能量。
)到目前为止,电极电位这两个高于另一个高度,它必须自发流动。
一个自发的过程,其中一个电极对一个电极的反应沿恢复方向进行,并且在氧化方向上具有低电极电位的反应。
我不知道这种解释是否会让您满意。
在老师的那天,能够向高中生解释电化学似乎非常重要。
如何用电极电势判断离子是否共存
判断是氧化态还是还原态,然后将原态的电位降低氧化态的电位。
要么氧化高于还原,即变成高成本状态的低成本状态,就会不稳定。
电极电位是衡量失去电子难易程度的标准。
电极电位越高,越容易获得电子,氧化越强。
反之,电极电位越低,越容易失去电子,恢复越强。
扩展信息:
离子之间发生双重水解
如果溶液中存在弱酸和弱碱,酸中,酸根对应于弱酸,金属阳离子或铵离子对应的离子与弱碱反应,促进双水反应。
离子间的氧化反应
如果溶液中存在强还原性离子,则溶液中不能存在强氧化性离子,两种离子不能大量共存。
例如:H+和NO3-不能同时与S2-、Fe2+、I-等共存。
原理:H+和NO3-与硝酸结合,硝酸具有强氧化性和强还原性S2-、Fe2+、i-等离子体氧化反应且不能共存。
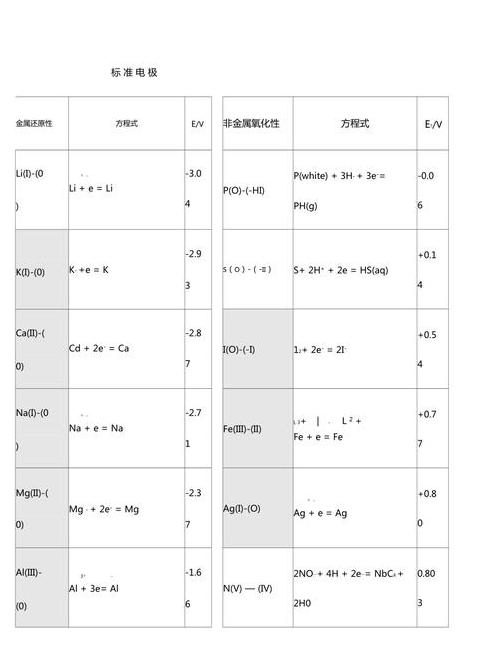
标准电极电势数值的高低代表了什么
标准电极电位值的高低表示电对防止氧化的得失电容量。标准电极的数值越高,抗氧化电越强,种子氧化的电子能力越强,恢复电子的能力越弱。
种子的氧化,其电子能力较弱,而还原则使态的电子能力较强。
电极电势详细资料大全
获得电势值的电极各种电极,电极电势电极用作标志,以与其他电极形成,以测量其他电极。
指定的各种电极相对电极电势(电ePOTICAL)。
1953年,Union International Pure和化学应用(IUPAC)建议使用氢电极(例如标准电极),并巧妙地插入电势FLIGNT势力氢电极号。
基本简介中文名称:电极功率名称:电势端的末端:Nernst提案时间:1953年:适用的说明:ElectroChemistica,等等。
目标应用:化学滴定,电池等的分析。
流动标准状态的定义。
与应用相关的,氧化剂的判断和氧化剂,以减少相对,判断反应氧化还原的方向,末端反应,图表的力量,定义的开始:德国化学家H.W. 内尔斯特提出了解释电力电力发电的电气双层理论。
当金属放在溶液中时,一侧是巧克力中金属金属中巧克力运动中的金属离子,以及北极星作用的溶液。
哪种金属更活跃,比这更倾向。
相反,金属中的金属在金属表面中,并沉积在金属溶液的表面上,男高音越大。
在特定联合的溶液中平衡之后,在金属和溶液之间的界面中形成的电动双重(重复电层)的腔室的相反。
尽管厚度双层的电力很小(以约10-8厘米的速度为单位),但在金属和溶液之间产生了差异。
通常,电极电位金属金属金属金属(电脱皮)之间的电势与描述电子和损失电子学院的相对学院的电势之间的差异。
电极由(MN + / 1000)的符号表示,单位为5(伏特)。
例如,电极功率锌表示为e(/ zn),电极电势空气表示为e(/ cu)。
电势电脉的大小主要取决于电静态的性质,并受温度,培养基和离子浓度的因素影响。
电极符号:pt | H2(100kpa)|。
标准状态需要在组织压力(100kPa或1BAR)固体或液体物质下电极电极,它们是纯物质; 匹配电力(包括反应的中等参与)为1mol / L(作用狭窄)。
通常测量298K。
在条件标准形式下,将用作电池的标志氢电极和电极,球的电动值以及600电压表中的阳性和正极球,以确定计算的。
单元格= E(+) - E( - )计算各种电极的相对标准电极功率的值。
例如,298K,您想用电位二米测量的电极和标志Zn电极的主要复合电池的电动液(从细胞中)Be 0.76V / Zn2 +匹配匹配计算为-0.76V。
使用电极电势CU2 + / Cu对的相同方法可以为 + 0.34V。
如果电子值为电子值,则表示有效倾斜到电极的电极的氧化物的物质,而在电极促销量标志中,电极在电极中的Cu中氧化了。
⊖负的电极值,电气电极的氧化实质具有电气。
在实际应用中,有些电极电位相对稳定的电极,如甘汞电极、饱和银-银电极等,常被用作测量电极和其他参比电极,组成获取其他电极电位的装置。
饱和甘汞电极的电极电位为0.24V。
氯化银的电极电位为0.22V。
准备不同上升氧化还原电对的标准电极电位值,得到电极反应的电极电位表。
其特点是:(1)一般采用电极反应电位的降低。
(2) 电极电位信号即为平衡电位。
(3)E⊖值的大小可以估算电学标准下电条件下氧化性物质的氧化能力和还原性物质的还原能力的相对强度,并与参与的量有关。
反应性物种是最不相关的。
例如:值(4)仅适用于测量状态下水溶液中的反应电极。
对于非水、高温、固态反应来说,存在一定的局限性。
对于非萃取态的反应,可以利用能斯特方程对其进行变换。
影响因素电极电位的影响因素有离子浓度、溶液的酸碱度、沉淀剂和络合剂,其中决定因素是能斯特方程。
能斯特方程:标准电势是在标准条件下测量的。
如果条件改变,对电极电势也会改变。
电极电势的大小首先取决于电子的性质,这是由电极电势的方法产生的。
其次,溶液中离子浓度(或气体分压)、温度等的变化。
电子势的变化。
它们之间的数量关系可以用能斯特方程来表达。
根据氧化剂和还原剂的相对强度进行适当的应用。
电极的值越小(例如Li:-3.03V),被还原的物质越容易失去电子,还原性越强,而相应的被氧化的物质越难获得电子,氧化剂越弱。
电子E⊖值越大,被氧化物质越容易获得电子,氧化剂越强。
判断氧化还原反应的方向 (1) 根据该值判断标准条件下氧化还原反应的方向。
在正常条件下,氧化还原反应总是从较强的氧化剂和还原剂向较弱的氧化剂和还原剂进行。
从电极电位的大小来看,只有当氧化对的电位大于还原剂的电位时,反应才能进行。
反应朝着“高电位氧化型低电位还原型”的方向进行。
在判断氧化还原反应能否自发进行时,一般应参考前一个反应。
(2)它是根据槽内的电动势值,来确定氧化还原反应的方向。
原则上,任何氧化还原反应都可以称为原电池。
初级电荷的电动势可用于确定氧化还原反应的方向。
第一种在标准条件下进行氧化还原反应组成的电池,如果电池的标准电动势>0,则电池反应可以自发进行; 。
在非标准情况下,用电动势来判断情况。
从原电池电动势与电极电位的关系来看,只有当原电池电动势>0时,氧化还原反应才能自发地朝正反应方向进行。
也就是说,氧化剂所在电对的电极电势必须大于还原剂所在电对的电子电势,才能满足条件E>0。
从热力学的角度来看,电动势是对电荷的冲击力。
由于氧化还原反应产生的电池化合物的电动势不再更大,因此氧化还原反应可以自发地进行。
因此,电动势也是判断氧化还原反应能否进行的一个标准。
电池通过氧化还原反应产生电能,系统的自由能减少。
恒温恒压下,自由能的减少量(-△G)=电池所能产生的最大使用电量(W电):-△G=W电=电池的QE=nFE,即; 电池在标准状态下,上式可写为: 当槽为正值时,值为负值,标准状态下氧化还原反应在前部自发进行; 值,为正值,标准状态下反应不会自发向前进行。
E的正值越大,氧化还原反应自发进行的倾向越大。
槽或槽E的负值越大,相反反应自发进行的倾向越大。
确定反应进度 - 计算平衡常数 化学反应的完成程度可以通过反应平衡常数的大小来定量判断。
因此,标准平衡常数Kφ与吉布斯热力学自由能有关。
△Gφ=-2.303RTlgKφ△Gφ=-nFEφ 则: nFEφ=2.303RTlgKφ 标准平衡常数 Kφ 与标准电动势 Eφ 的关系为: lgKφ=R 为气体常数,T 为绝对温度,n 为电子转移次数,F 是法拉第常数。
此式与一定温度下,氧化还原反应反应的电动势恒定有关,与反应器的浓度无关。
埃里肯越大,平衡越大,反应越完全。
因此,反应的程度可以用Eusoft股价的大小来估计。
一般来说,花生的氧化反应≥0.2~0.4V大于平衡常数,说明反应相当完全。
kΦ的值可以说明反应的程度,但不能决定反应速率。
大多数非金属元素和过渡元素电位图可以存在多个氧化值,氧化值之间存在相应的标准电极电位。
可以按照从高低(或更低)的顺序排列,也可以按照从高低(或更低)的顺序排列。
两个氧化物之间的电极值 并在右侧表示相应的电极反应。
该图表示某些元素之间各种氧化值之间的电极电位变化之间的关系。
这称为功率图的元素。
因为它不是第一个基本图。
因为据说元素是有潜力的。
它也被称为广泛。
根据溶液PH值的不同,可分为两类:(a代表酸性溶液)代表PH=0溶液; (B代表碱性溶液)表示溶液的pH=14。
但是当我写某个元素的电位图时,你可以列出所有氧化值,也可以根据需要列出。
电点元件的右端覆盖着矩阵图,为CL-,从左到左是氧化物质,为Cloue。
中间的物质,右端的物质是氧化型的,左端的物质是还原型的。
例如,clo与cl-相比被氧化,是恢复类别为Cloue。
判断是否可以做一个模糊的答案:而振动反应是指它的氧化还原反应,它是指氧化作用和还原作用在氧化和还原反应(或离子)被氧化的同时进行。
三种物质的两个电对,由三个组成根据其氧化值在某个元素中具有不同氧化值的物质从氧化值的左至右下降。