微积分视角下的电荷守恒定律解析
怎样用微积分解释电荷守恒定律?
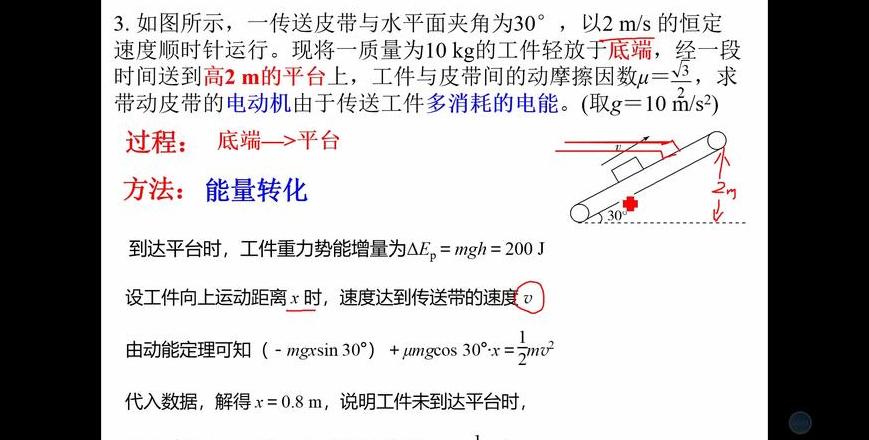
解题过程如下图:
电荷既不能删除它。
它只能从一件事转移到一件事,或者从一件事转移到另一件事。
在迁移过程中,系统的总数没有变化。
subming 2:
尚未准备好外界世界的系统并不总是代数。
费用:您要收取多少费用? 单位:Kulun C
至少是通过电子带来的钱的数量。
金属费用 - 最低费用:表示E = 1.60x10-19c。
收取的所有电荷等同于E或E的系数。
因此,不断更改电荷量。
不。
氯化铝的物料守恒 电荷守恒 质子守恒
物质守恒为:n(alcl3)=n(al3+)+n(al(OH)3); (H+)=n(OH-)+3N(Al(OH)3)。这三种平衡是溶液中的常见平衡,它们可以归因于质量守恒定律。
质量守恒定律最早由俄国科学家罗博诺索夫于1756年发现。
拉维斯通过大量的定量试验发现,化学反应中参与反应的物质的总质量等于该物质的总质量反应后。
该法称为质量保证法。
也称为物质不朽法则。
这是自然的基本法则之一。
在任何与周围环境隔离的系统中,无论发生什么变化或过程,整体质量始终保持不变。
也就是说,任何变化都包括化学反应和核反应,不能消除物质,而只是改变物质原有的形态或结构。
化学反应的过程是参与不同物质(反应)的原子进行反应再生成其他物质的过程。
在化学反应中,反应前后原子的种类没有改变,数量没有增加或减少,原子的质量也没有改变。
在化学反应过程中,反应前后原子的种类没有改变,原子的数量没有增加或减少,原子的质量没有改变。
因此,化学反应前后物质的质量总和必须相等。
①化学变化中“一定不变”:原子类型、原子数量、原子质量、元素类型、元素质量以及反应前后各种物质的总体质量必须保持不变; 化学变化中可能发生的变化:分子的数量可以发生变化并元素化。
适用范围:①质量守恒定律的范围是所有化学变化,包括大多数物理变化;物体的体积不一定是保守的;定律:在化学中,反应是指反应前各物质的总质量等于反应后各物质的总质量。
电荷守恒定律微分形式电荷守恒定律公式
很多人还不了解支付保护法和支付保护法公式。1、电荷守恒是指溶液中所有正电荷之和等于所有负电荷:一价正离子 + 2* 二价正离子 + 3* 三价正离子 + = 一价负离子 + 2* 二价负离子 + 3 *三价负离子+ 保护物质是指保护物质。
沉积的A元素数量=溶液中所有A元素的总数 例如,如果加入1molNaH2PO4,则电荷守恒方程为:H(+)+Na(+)=OH(-)+3*。
PO4(3-)+2 *HPO4(2-)+H2PO4(-) Na元素的物质保护:1mol=Na(+)是H元素的物质保护 [H(+)在水中电离但H(+)在水中电离 如果没有 OH (-) 电离,则从左侧表达式中减去 OH(-) 就是原料贡献的全部: 1mol-OH(-)=H(+)+HPO4(2-)+2*H2PO4(-)+3*H3PO4P 为物质守恒: 1mol=PO4(3-)+HPO4(2- )+H2PO4( - )+H3PO4。
4种化学物的物料,电荷,质子守恒
化学溶液中的电荷守恒定律指出,添加到溶液中的质量的总离子电荷等于阴离子的负电荷。例如,NA2s溶液的电荷守恒为(NA +] + 2 [H + 2) [H + 2] + [S2 -] + [HS-],代表H + 离子浓度。
[OH-ion]表示oh-离子的存在。
物质守恒是指无论如何,溶液中存在的元素总量保持不变,以NA3PO4为例。
常数物质守恒公式为 [na + +] = 3 [hppo4] + [hppo4) + [HPPO4] + [H2PO4 -], 3-], [(HPPO4) 2-], [H2Po4-]], [H2Po4 -]],对质子守恒的是氢离子和氢氧化物溶液中的氢离子 该解决方案的重点是分配氢离子以确保离子平衡。
例如,Nahco3 溶液中的守恒方程为 [(CO3) 2-] =] =] =] = [H2Co3]),其中 [(co3) 2-] 表示碳酸根离子的浓度。
[H2CO3]代表 碳酸盐分子浓度。
同样,Na2hpo4 溶液中的质子守恒方程为 [OH-] + [(PO4) 3-] = [H2Po4 -] + 2 [H2PO4] + 2 [h3po4] + [h3po4]] 离子含量,[(HPPO4) 2 -][(H2Po4)]表示DiHydronone离子和氢二磷酸作用离子和氢作用离子的浓度。
通过这些守恒定律,化学家可以研究生物化学,可以准确分析和可理解的环境科学和工业化学教育教育的复杂化学解决方案。
对各种化学反应的适当维护; 这些法律提供了强大的设备,不仅可以了解化学物质之间的相互作用,还可以设计最大的化学过程。
例如,这些定律用于确保药物配方在药物生产中的安全性和有效性。
它可以帮助科学家理解和解决环境科学问题问题的问题。
改善机械化学生产过程的生产过程。
提高有效性并减少废物。
不久,保存支持中心;
电荷守恒定律的公式是什么?
电荷守恒定律的公式如下:
c(H+)=c(OH-)+c(NH3 ·水)。
溶液中的H+来自两部分,一部分是水的电离,其浓度等于OH-的浓度。
水解的另一部分是NH4+,以等于NH3·H2O的浓度排出。
NH4++H2O=可逆=NH3·H2O+H+。
电荷守恒:溶液中所有阳离子的正电荷等于所有阴离子的负电荷。
材料守恒:一些离子可以在溶液中水解或电离并保持守恒。
质子守恒:水电离的H+和OH-离子数量相等。
扩展信息:
电荷守恒、物质守恒、质子守恒是解中相同的三大守恒关系。
1。
2溶液呈电中性:所有阳离子所带正电荷数等于阴离子所带负电荷总数。
3. 该产品部分水解。
4.
例如:NaHCO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)。
因为碳有两个负单位,所以碳之前是2。