原子电子运动轨迹揭秘
揭秘电子在原子中的运动轨迹
揭示原子中电子的轨道 原子中电子的轨道是什么? 上世纪初,卢瑟福提出了原子的行星模型,认为电子围绕原子核运动,就像行星绕太阳运行一样。然而,该模型忽略了电子质量改变和电子轨道变化的可能性。
后来,薛定谔的电子云模型试图描述原子中电子的分布,但完全忽略了电荷之间静电力的规律,使得预测电子轨道变得难以捉摸。
事实上,通过实验观察我们知道,在静电引力的作用下,原子核和电子相互靠近,同时在磁力的作用下,它们开始相互旋转。
最后,电子和原子核以螺旋路径相互接近。
在原子核强大的静电引力作用下,电子通过“裂变”的过程释放出光子,并进行反冲,避免被吸进原子核,形成稳定的原子体系。
。
电子在绕原子核运动时,不断受到光子的干扰,导致电子在吸收光子时远离或靠近原子核,导致电子绕原子核的轨道始终发生变化。
很多人迷信“光子没有静止质量”,认为电子的质量不会改变。
这种观点阻碍了原子光谱学的突破。
要了解电子转变为不同稳定轨道的根本原因,我们需要从电子的内部结构开始。
电子和原子核具有特定的内部结构特征,正如原子核具有“幻质量数”一样,电子也具有“幻质量数”,这是质量与结合力之间的特定关系。
电子的这种内部结构特征使得它们在原子核的静电引力作用下,通过“裂变”释放光子来进行反冲,避免被原子核吸引,从而保持稳定的轨道。
此外,电子在吸收光子方面具有选择性,这说明电子可以吸收特定能量的光子并在特定条件下改变其轨道。
原子核和电子内部结构的另一个特征是存在“极限质量”。
电子不能无限地吸收光子以增加其质量。
超过这个质量的电子变得不稳定,并在很短的时间内“裂变”释放光子。
这一性质符合微观粒子内部结构的普遍规律。
在原子中,电子可以吸收特定能量的光子,从一个“神奇质量”位置跳跃到另一个更远的位置,或者从更远的位置返回到更近的位置。
物理学的这四个分支,特别是光子在嘴唇中传播的速度不同的领域,分子动力学理论和热现象的本质,电子内部结构和原子光谱问题,以及光电效应,都是基于对这种现象的深入研究。
。
原子核和电子之间的相互作用为电子绕原子核运行提供了初速度。
静电力使它们沿直线相互吸引,而磁力使它们旋转,最终形成一个稳定的物体。
原子系统。
在宏观世界中,带电粒子之间的磁力可以忽略不计,不足以影响它们的运动。
因此,宏观带电粒子通常沿直线运动。
电子之所以不落入原子核,在于静电引力的撕裂效应与电子内部束缚力之间的动态平衡,当电子受到扰动时,它们通过过程“裂变”过程释放出光子以获得反冲力来维持。
稳定。
不同质量的电子对不同质量的光子的吸收率存在差异,这可以解释原子光谱的现象。
外层电子由于其“饥饿感较低”而更有可能吸收较高质量的光子,而内壳电子由于其“饥饿感较高”而更有可能吸收较低质量的光子。
这解释了为什么原子光谱中不同能级的电子以不同的速率吸收不同波长的光子。
从宏观角度来看,分子动力学理论解释了温度对化学反应速率的影响,但无法解释“反应激活分子”数量的增加。
原子核和电子之间的相互作用为化学反应的能量转换过程奠定了物理基础,温度升高会增加分子间压力,帮助电子更容易到达原子核,从而释放光子并影响化学反应。
摩擦加热的基本原因可以从微观角度解释为分子相互碰撞时施加在原子上的压力,导致电子接近原子核并释放光子,将机械能转化为热能。
液体折射率随温度升高而降低的原因是,温度升高导致电子远离原子核,可见光中与光子的结合力减弱,光子停留时间变短,导致。
到较低的折射率。
光电效应的微观解释涉及光子和电子之间的相互作用。
爱因斯坦提出光电效应方程,解释了光子能量与电子初始动能之间的关系。
然而,光子理论在解释高能光子与原子外层电子的电离问题以及电子吸收大量低能光子的机制方面存在缺陷。
同时。
通过实验和理论研究,我们逐渐对这些现象背后的物理原理有了更深入的了解。
电子绕核运动轨迹是圆还是椭圆
同意上面的观点。如果是单个原子,它的轨道是标准椭圆轨道,遵循开普定律。
自然界不具备这样的条件,也无法被观察到。
当电子靠近原子核时,它们绕原子核接近圆周运动,观察到电子云; 当它们远离原子核时,它们的轨道会受到各种干扰的极大干扰。
核心周围的椭圆度应该与材料的温度有关。
如果温度高,椭圆的两个焦点就会相距很远。
许多学者认为,太阳风是由太阳上核爆炸引起的物质喷射引起的。
这些材料带电质子。
另一种解释是核爆炸导致温度升高并改变电子轨道。
高速电子被大量向外“喷射”。
运动过程遇到质子,将它们一起向外“弹射”出去,所以观察到的是带电质子的太阳风!
原子中电子是怎样绕着原子核运动的
原子中的电子以接近光速的速度绕原子核运动。
电子具有波粒二象性。
我们无法确定它是在空间的某一点,就像描述普通物体的运动一样。
我们只能告诉它在核外某处的概率(即概率的大小)。
电子在原子核内各处出现的概率不同,有的地方出现的概率很低,如果电子在原子核外各处出现的概率不同 黑点(出现的概率越高,越密集小黑点将会出现,从而产生稍微平滑的图像。
在这些图像中,原子核似乎被带负电的电子云覆盖,因此称为电子云。
在原子中,电子和质子由于电磁力而相互吸引。
这种力将电子束缚在原子核周围的静电势中,并且势阱需要外部能量。
电子距离原子核越近,吸引力越大。
因此,靠近原子核的电子比外壳中的电子需要更多的能量来逃逸。
原子轨道是描述原子核中电子概率分布的数学方程。
实际上,只存在一组不同的(或量子化的)轨道,其他可能的形式很快就会崩溃为更稳定的形式。
这些轨道可能包含一个或多个环或节点,并且它们大小、形状和空间方向各不相同。
很多人都搞不清,电子到底是怎么绕原子核运动的?
大多数人不明白电子如何绕原子核运动。事实上,大多数人不知道电子在原子之外是如何工作的。
今天许多人错误地认为电子围绕分子的运动与地球围绕太阳的运动相同。
他们可能了解玻尔的能级跃迁模型和电子云模型,但他们仍然不知道电子如何移动。
然后我们开始分析玻尔的能级跃迁。
电子从一个轨道跳跃到另一轨道,跳跃过程被中断并且没有连接。
关于原子轨道的分歧
这里必须要解决一个概念。
许多人错误地认为原子轨道是电子核外电子壳层的轨道。
实际上,这1、2、3“轨道”并不是原子轨道,它们也被称为能量壳层,也称为电子壳层。
第一层也称为K层,第二层为L层,第三层为M层(以此类推)。
每个电子层(能量层)包含不同类型的能级,电子层中的能级数量取决于电子层的数量。
例如,第一电子层(K)只有一个能级。
第二电子层 (L) 有两个能级(依此类推)。
由于能级位于电子壳层(能量壳层)以下,因此能级也称为电子子壳层。
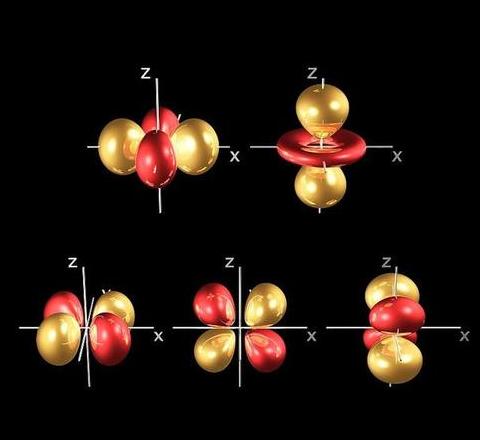
能级本身就是初中化学的s、p、d、f原子轨道。
例如,第一电子壳层只有一个能级,这个能级就是s轨道。
第二电子层只有一个能级,这两个能级分别是s轨道和p轨道。
第三电子层具有三个能级,这三个能级是s、p和d轨道。
其余的电子层可以按顺序取出。
但需要注意的是,第二电子层有两个能级,即s和p2原子这并不意味着它们只是轨道。
除了s轨道外,其他轨道都有自己的复制功能(严格来说是空间趋势)。
轨道是圆形的这种类型的轨道不能轻易地自我复制并且不能独立存在。
p轨道的形状是双形。
d轨内置五重复制功能,所有五个d轨同时发生。
spdf 轨道副本的缩放是根据 1、3、5、7 等奇数计算的。
实际上,所谓的 spdf 轨道仅代表电子云的不同形式。
电子更容易出现在某个地方,而这个地方就形成了某种形状。
例如,s轨道形状像球体,p轨道形状像哑铃,d轨道形状像花瓣。
现在我们知道了原子轨道的类型,我们需要了解电子如何占据这些轨道。
事实上,电子占据原子轨道的过程主要是由极排斥原理和汉特定律引起的。
泡利不相容原理告诉我们,一个原子轨道最多可以容纳 2 个电子。
例如,第一电子层(K层)只有一个能级,而这个能级中只有一个s轨道,因此只能容纳2个电子。
第二电子层(L层)有s和p2能级,1个s轨道和3个p轨道,总共4个原子轨道,因此最多可容纳8个电子。
有s、p、d三个能级,因此有1个s轨道,3个p轨道,5个d轨道,总共9个原子轨道。
轨道,因此最多可容纳 18 个电子。
自然界中,一切事物都追求完美和稳定,现在不稳定,永远稳定。
因为相对稳定的事物变化很小,而不稳定的事物变化很大,所以大的变化总是会导致小的变化。
这一原理也适用于物理学,其中相对稳定的状态意味着低能量。
洪特定律基本上是最小动能原理,它指出电子总是占据能量最低的原子轨道,并且别无选择,只能占据有效能量最高的原子轨道。
理解了汉特法则后,剩下的就是各个原子轨道的能量这是一个比较。
这就是这个原子轨道的能量的样子。
1s是第一电子层的轨道,2s是第二电子层的轨道。
2p是第二电子层的p轨道(第一电子层没有p轨道)。
2p 小于 3p 且小于 4p。
根据纵向比较,3s比3p小,比3d小。
根据垂直和水平堆叠的比较,涉及到动能堆叠的原理。
从第四个电子壳层开始,4s 变得小于 3d。
下面的能量叠加和对比可以通过单独收集数据来完成,不再赘述。
深入准确地理解泡利不相容原理您是否想过为什么泡利不相容原理的原子轨道只能容纳2个电子? 首先想一想,原子外部分布着很多电子,这些电子是一样的吗?
只是感觉所有电子看起来都一样。
根据基本方法,我们不应该判断2个电子之间的差异。
但如果我按逻辑思考,毫无疑问电子之间存在差异。
事实上,电子之间的差异太多,无法区分。
因此,应该开发一种特殊的方法来用电子识别号码来标记它们。
因此,量子数可能有多种类型。
然而,对于非核电子,通常有四种不同类型的电子,因此有四个量子数。
如果两个电子具有相同的四个量子数,则它们具有相同的量子态,并且不能处于相同的原子轨道。
这是对保罗排除原则的严肃而详细的描述。